La etiopatogenia (causa u origen) de la Degeneración Macular Asociada a la Edad (DMAE) es bastante compleja. Su conocimiento no es completo y actualmente sigue en estudio (17), pero se puede resumir describiendo cuatro procesos que contribuyen a la enfermedad, teniendo también en cuenta la predisposición genética: lipofuscinogénesis, drusogénesis, inflamación local y neovascularización (18).
Lipofuscinogénesis: La creciente disfunción del EPR debida a la edad produce alteraciones metabólicas en las propias células del EPR, lo cual conlleva a la progresiva acumulación de lipofuscina, es decir, la lipofuscinogénesis. La lipofuscina son gránulos compuestos principalmente de lípidos (50%) y proteínas (44%) procedentes de la fagocitosis de los segmentos externos de los fotorreceptores (19). La lipofuscinogénesis está modulada por dos factores: la exposición a la luz y los niveles altos de oxígeno en la retina. La relación entre los procesos oxidativos y el desarrollo de atrofia geográfica ha sido confirmado en pacientes que sufrieron DMAE (20).

Figura 1: Afección de los fotorreceptores en una mácula normal, la DMAE seca así como en la DMAE húmeda. Tomada de (21)
La formación de drusas, drusogénesis, es un proceso lento, complejo y multifactorial que provoca directamente alteraciones estructurales en el EPR, e indirectamente activación del sistema inmune e inflamación local (22). El análisis inmuno-histoquímico de las drusas revela la presencia de numerosas moléculas asociadas al sistema inmune. Tiene especial importancia la presencia de componentes de la cascada de complemento (especialmente el factor H del complemento, CFH), y los complejos de ataque a la membrana del complemento. Dichas moléculas son producidas localmente por el EPR, la coroides y la retina (23). El CFH inhibe la activación del complemento, por lo tanto su ausencia, mutación o baja actividad pueden provocar el desarrollo de inflamación local que estimule la drusogénesis (24).
La neovascularización es otro proceso característico de la DMAE. Su aparición se puede explicar de forma resumida de la siguiente manera:
En condiciones normales existe un equilibrio entre factores pro-angiogénicos (factor de crecimiento endotelial vascular o VEGF) y antiangiogénicos (factor de crecimiento derivado del epitelio pigmentario o PEDF), aunque dicho equilibrio puede romperse en situaciones de hipoxia o isquemia. El VEGF es una citoquina que incrementa la permeabilidad vascular y la respuesta inflamatoria. Especialmente el VEGF165 juega un papel muy importante en la rotura de la barrera hematorretiniana. En el caso de la DMAE son las reacciones inmunes junto con los procesos de inflamación local los que provocan el desequilibrio entre los distintos factores (25).
Como consecuencia de las alteraciones etiopatogénicas descritas anteriormente, las lesiones del EPR que se producen en la DMAE dan lugar a los depósitos laminares basales y a las drusas duras que pueden progresar hacia una atrofia geográfica del EPR; o hacia una degeneración disciforme caracterizada por la presencia de drusas blandas y membranas neovasculares coroideas (MNVC). (figura 2) La primera constituye la forma seca de la enfermedad y la segunda la forma húmeda (26).
La existencia de drusas duras o de atrofia geográfica supone un riesgo de sufrir alteraciones más graves; así, el riesgo de aparición de complicaciones neovasculares en los pacientes con forma atrófica bilateral es del 2% a los dos años y del 11% a los cuatro años. Cuando el primer ojo presenta una MNVC, el riesgo de bilaterización es del 34% a los 4 años (27) . Esta neovascularización nunca se origina dentro de la zona atrófica, sino que habitualmente lo hace en los bordes (28) .
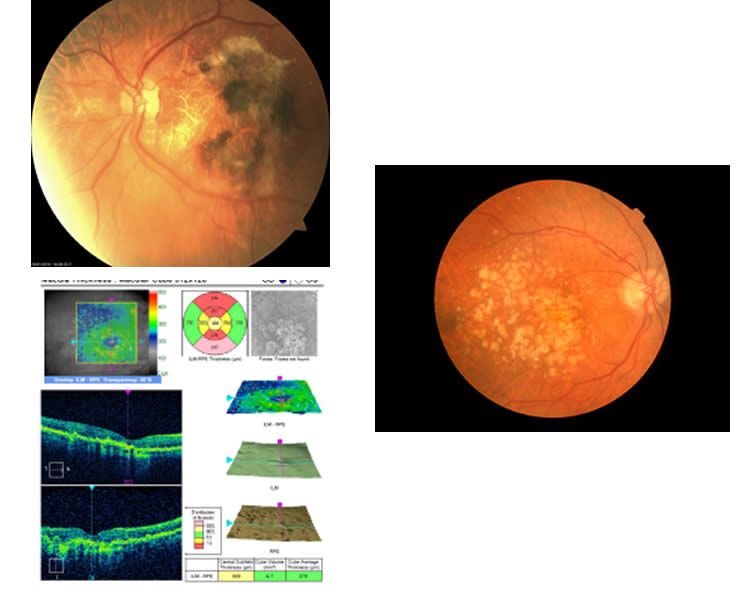
Figura 2. Retinografía de ojo izquierdo característica de la DMAE húmeda, a su derecha observamos la retinografía de ojo izquierdo típica de la DMAE atrófica o seca donde se pueden observar drusas. Tomografía de coherencia óptica (OCT) de ojo derecho tomada en un Cirrus-HD; se puede observar una atrofia del EPR con un importante adelgazamiento y drusas en el área macular. Esto indica una DMAE seca o geográfica
La DMAE húmeda o exudativa se produce por la aparición de neovasos que proliferan desde la coriocapilar y atraviesan la membrana de Bruch para situarse por debajo del EPR o de la neurorretina (figura 3). Este hecho, da lugar a la rotura de la barrera hematorretianiana externa, con la aparición de hemorragias subrretinianas que conducen a la destrucción de EPR y de los fotorreceptores. Al mismo tiempo, induce la proliferación de tejido fibroso produciendo una cicatriz disciforme. Aun afectando a un 10% de los pacientes con DMAE, es responsable del 90% de las disminuciones graves de agudeza visual.
Como signos y síntomas que acompañan a esta patología se encuentran las metamorfopsias, macropsia o micropsia, alteraciones del color o escotomas centrales. Todo lo anterior dificulta la realización de tareas de la vida diaria como leer, conducir, reconocer caras o realizar tareas finas.
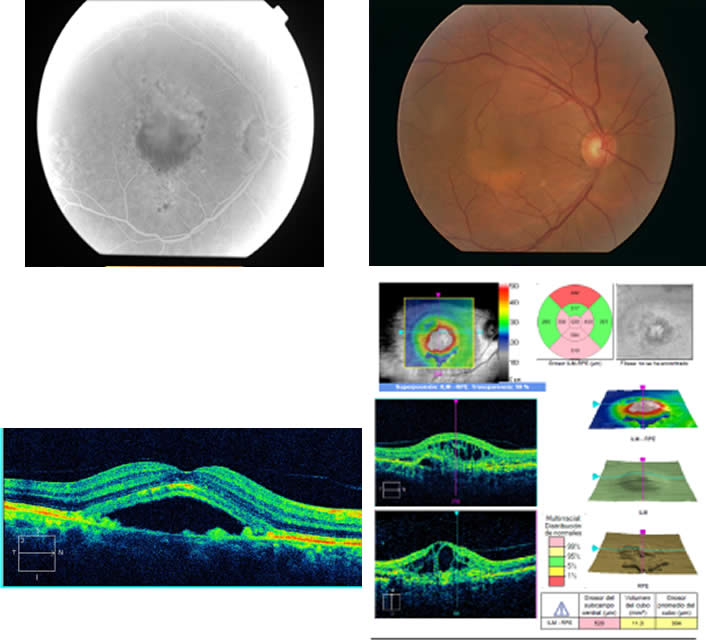
Figura3. La siguiente figura fue tomada a un mismo paciente/ojo al que se le realizó una AFG, OCT y una retinografía en OD; observándose un desprendimiento del EPR con un cúmulo de líquido subretiniano. En la AFG se observa hemorragia macular y edema lo cual indicaría que la MNV está activa. Este caso indica que es una DMAE húmeda o exudativa
Bibliografia:
(17) Nussenblatt RB et al. Age-related macular degeneration and the inmune response: inplication fot therapy. AM J Ophthalmol 2007;144:618-26.
(18) Nowak JZ. Age-related macular degeneration (AMD): pathogenesis and therapy. Review. Pharmacol Rep 2006;58:353-63.
(19) Sparrow JR et al. RPE lipofuscin and its role in retinal pathobiology. Exp Eye Res 2005;80(595):606.
(20) .Shen JK DAHS. Oxidative damage in age-related macular degeneration.. 2007 Dec; 22: 1301-8. Histo Histopathol 2007;1301(1308).
(21) Luis Emilio Abad. La mácula cambios degenerativos. 2007.
(22) Anderson DH et al. Role for local inflammation in the formation of drusen in the aging eye. Ophthalmol 2002;134:411-31.
(23) Mullin RF et al. Drusen associated with aging and age-related macular degeneration contain proteins common to extracellular deposits associated with atherosclerosis, elastosis, amyloidosis and dense deposit disease. FASEB J 2000;14:835-46.
(24) Hageman GS et al. An integrated hyphotesis that considerers drusen as biomarkers of inmune mediated processes at the RPE-Bruch´s membrane interface in aging and age-related macular degeneration. Review. Prog Retin Eye Res 2001;20:705-21.
(25) Adamis AP et al. The role of vascular endothelial growth factor in ocular health and disease. Retina 2005;25:111-8.
(26) Triviño A et al. Fisiología de la degeneración macular asociada a la edad. editores. La mácula senil. Barcelona: Edika-Med; ed. 1993. p. 25-33.
(27) Sunness JS et al. Visual function abnormalities and prognosis en eyes with age-related geographic atrophy of the macula and good acuity. 1997; 104: 1677-91. Ophthalmology 1997;104:1677-91.
(28) Cohen SY et al. Incidente et pronostique des néocaisseaux sous rétiniens Dans le fomes atrophiques de dégénérescence maculaire liée à l`age. Bull Soc Ophtahlmol Fr 1992;92:261-7
fuente: DMAE y Población 2020
Virginia Carrillo Ramos
Vanesa Blázquez Sánchez

Pingback: Tratamiento de la Degeneración Macular Asociada a la Edad (DMAE) | Cosas de Ojos